É um tumor maligno que se desenvolve no período da lactância e da infância no(s) rim(ns). Difere dos tumores renais primários que surgem na idade mais avançada quanto ao desenvolvimento e à histologia. Algumas dessas diferenças devem-se à incidência; ao tipo de tumor; à sua relação entre a teratogênese (desenvolvimento anormal) e a oncogênese; e ao grande número de pacientes que apresentam aberrações familiares ou genéticas subjacentes.
O desenvolvimento do tumor de Wilms apresenta aspectos relevantes dos tumores infantis, ou seja, apresentam relação entre as malformações e as neoplasias e entre a organogênese e a oncogênese. Esse tipo de doença avenca possibilidades para as modalidades de tratamento criterioso, afetando o prognóstico e o resultado (ler “PROGNÓSTICO”).
EPIDEMIOLOGIA
Segundo o INCA (Instituto Nacional do Câncer), os tumores renais representam cerca de 5% a 10% de todas as neoplasias infantis, sendo que o mais frequente, cerca de 95%, é tumor de Wilms. Nos Estados Unidos, 1 em cada 10 000 crianças são acometidas pelo tumor. O pico de incidência ocorre entre 2 e 5 anos e pelo menos 95% ocorrem antes dos 10 anos de idade.
De 5 a 10% dos pacientes com tumor de Wilms apreseenta ambos os rins acometidos, o que ocorre de maneira sincrônica (ou seja, concomitantemente) ou metacrônica (em períodos diferentes). Quando há o desenvolvimento do tumor nos dois rins, estes surgem em média 10 meses mais cedo do que nos pacientes em que apenas um rim é afetado.
CLÍNICA
O diagnóstico de tumor de Wilms pode ser retardado pela capacidade que a tumoração tem de crescer sem causar dor, e a criança pode parecer saudável. No entanto, uma massa abdominal grande passa a ser visualizada, uni ou bilateral, e que pode ultrapassar a linha média e seguir abaixo da pelve. Alguns outros sintomas podem surgir no paciente com tumor, como hematúria, hipertensão, obstrução intestinal e dor abdominal após um traumatismo local. Uma parcela significativa dos pacientes, quando diagnosticados, já apresentam metástases pulmonares.
MACROSCOPIA
Consiste em uma massa grande e bem circunscrita. Ao corte, apresenta superfície mole e homogênea, de coloração parda a cinzenta, com focos ocasionais de hemorragia, necrose e/ou formações císticas.
 |
| São visualizadas áreas de hemorragia. Fonte: http://www.health.act.gov.au/c/health?a=da&did=11011282&pid=-5753243 |
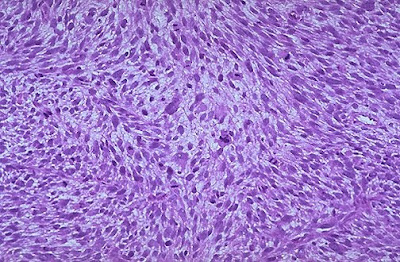
MICROSCOPIA
Visualmente caracterizam-se por “uma tentativa de recapitular diferentes estágios da nefrogênese”. Assim, são observadas as três fases clássicas do desenvolvimento renal, que são: blastêmica, estromal e epitelial. As células estromais são de natureza cística ou fibróide. A porcentagem de cada componente é variável.
Há o desenvolvimento de túbulos e glomérulos renais abortivos. Outros elementos heterólogos são raramente observados, e incluem músculo liso, epitélio mucinoso, epitélio escamoso, tecido osteóide ou cartilaginoso, tecido adiposo e tecid neurogênico.
Quando há a apresentação microscópica de anaplasia, considera-se que haja uma mutação no p53, sendo um tumor marcadamente resistente à quimioterapia. São caracterizadas por células grandes, hipercromáticas, com mitoses anormais e núcleos pleomórficos.
 |
| Fonte: http://www.pathologyoutlines.com/images/kidney/1_055.JPG |
 |
| Microscopia: característica anaplásica de um tumor de Wilms. Observam-se células grandes e pleomorfismo. Fonte: http://webpathology.com/image.asp?n=4&Case=73 |
IMUNOISTOQUÍMICA
Positivo: blastema - desmina, WT1. Não positiva para marcadores musculares. Vimentina focal
 |
| Há uma expressão nuclear de SMARCB1/INI1, confirmando o diagnóstico de Tumor de Wilms Fonte: http://www.nature.com/modpathol/journal/v19/n5/fig_tab/3800581f4.html#figure-title |
ESTADIAMENTO
Segundo o National Wilms Tumor Study Group, o estadiamento consiste em 5 estágios, como é apresentado no quadro que segue:
PLOIDIA, CITOGENÉTICA E GENÉTICA
Alguns grupos de malformações congênitas e mutações cromossomiais estão envolvidos na gênese do tumor de Wilms. Dentre elas, destacamos:
1. Síndome WAGR: aniridia (ausência da íris) + anomalias genitais + retardo mental
Essa síndrome constitui em 33% de chance de desenvolver o tumor. Portadores de deleções (germinativas) constitucionais do 11p13 estão relacionados à síndrome e a esse risco aumentado. Associado a essas alterações estão os genes WT1 e PAX6 (gene dominante autossômico deletado contiguamente à aniridia). Quando o paciente apresenta alteração em PAX6 e não em WT1 não há risco aumentado para o desenvolvimento do tumor. Quando há a mutação de WT1, é necessa´rio que haja uma segunda mutação (sem sentido ou frameshift) no alelo para tumor de Wilms.
2. Síndrome de Denys-Drash: disgenesia genital (pseudo-hermafroditismo masculino) + nefropatia de aparecimento precoce (levando à insuficiência renal)
Esses pacientes também apresentam anomalias no gene WT1 que aumentam em aproximadamente 90% o risco de desenvolver o tumor de Wilms. Contudo, as alterações no WT1 consistem em mutação negativa dominante de sentido errôneo na região zinc-finger do gene, afetando a ligação do DNA. O surgimento do tumor indica a mutação bialélica de WT1 na síndrome.
3. Síndrome de Beckwith-Wiedmann: organomegalia (aumento dos órgãos) + macroglossia + hemi-hipertrofia + onfalocele + citomegalia adrenal (células grandes anormais no córtex da adrenal)
3.a) A região cromossômica envolvida foi localizada na banda 11p15.5 (WT2), distal ao lócus WT1. Há um risco aumentado no desenvolvimento do tumor se for heterogêneo, sendo a tumorigênese influenciada pelas anomalias do imprinting (transcrição silenciosa) de WT2.
3.b) A mutação no regulador do ciclo celular (CKDN1C ou p57 ou KIP2) pode levar os portadores da síndrome de Beckwith-Wiedmann a desenvolver o tumor de Wilms. Quando comparado aos pacientes com mutação no WT2, possuem risco menor de desenvolvimento do tumor.
4. Mutações por ganho de função do gene que codifica a β-catenina tem sido mostrada em aproximadamente 10% dos tumores de Wilms esporádicos. A β-catenina pertence a via de sinalização “wingless” (WNT).
PROGNÓSTICO
Houve um importante aumento na taxa de cura para tumor de Wilms, sendo considerado um dos maiores sucessos da oncologia pediátrica. Em poucas décadas a taxa saltou de 30% para os atuais 85% de cura. A histologia anaplásica confere um risco aumentado para recorrência e morte. A perda do material genético dos cromossomos 11q e 16q e o ganho do material no cromossomo 1q – nas células tumorais – representam um prognóstico também desfavorável.
Especula-se que haja um risco relativamente elevado para o desenvolvimento de outros cânceres (primérios), como ósteossarcoma, câncer de mama e leucemia., podendo estar relacionado tanto a uma predisposição de caráter genético quanto ao próprio tratamento contra o tumor de Wilms.
Outras características tornam o prognóstico reservado, como: tumor de grande tamanho, idade do paciente maior que 2 anos e diagnóstico em estágio avançado da doença.
REFERÊNCIAS
1. Robbins & Cotran; Patologia: Bases Patológicas das Doenças; 8ª Edição, 2009
2. http://www1.inca.gov.br/estimativa/2010/index.asp?link=conteudo_view.asp&ID=5
3. http://www.pathologyoutlines.com/kidneytumor.html#wilmkids
4. http://www.hcanc.org.br/index.php?idTipoCancer=26&page=14
Audinne Ferreira e Silva
Acadêmica de Medicina
Liga de Patologia
Universidade Federal do Ceará